- Menú
- RESTAURACIÓN CTS
- CONSERVACIÓN Y ARCHIVO CTS
-
CTS FOCUS
- PARTNERSHIP
- NOTICIAS Y NOVEDADES CTS
- REALIZACIONES
- SOBRE NOSOTROS
-
OFERTAS ESPECIALES CTS
- SOSTENIBILIDAD
- CONTÁCTANOS
8.2 MÁS INFORMACIÓN - AQUÍ UN VIEJO CONOCIDO: EL ÓXIDO
-
PARA RESTAURACIÓN
- Resinas Sintéticas Acrílicas
-
Resinas Sintéticas Epoxídicas
- WATER EPO / K WATER
- ADHESIVO 5 MINUTOS EPOXY (PRODUCTO BICOMPONENTE)
- ARALDITE® SV 427 (REN PASTE SV427) (PRODUCTO BICOMPONENTE)
- ARALDITE® 2020 (PRODUCTO BICOMPONENTE)
- BALSITE® (W + K) (PRODUCTO BICOMPONENTE)
- EPO 121 (PRODUCTO BICOMPONENTE)
- EPO 127 - RESINA PARA MADERA (PRODUCTO BICOMPONENTE)
- EPO 150 (PRODUCTO BICOMPONENTE)
- EPO 155 (PRODUCTO BICOMPONENTE)
- UHU® PLUS Endfest 300 (PRODUCTO BICOMPONENTE)
- UHU PLUS 5 MINUTOS
- Resinas Sintéticas Poliésteres
- Resinas Sintéticas Vinílicas
- Resinas Sintéticas Varias
- Resinas Naturales - Ceras
- Resinas Naturales/Gomas/ Látex
- Aditivos y Cargas (para Resinas)
- Reforzantes de Fibra de Vidrio (para Resinas)
-
Consolidantes
- ACRISIL 201/O.N.
- ACRILMAT
- BARIO HIDRATO (HIDRÓXIDO DE BARIO)
- DISOLVENTE AC 204
- ESTEL 1000 - CONSOLIDANTE A BASE DE SILICATO DE ETILO
- ESTEL 1100 - CONSOLIDANTE E HIDROFUGANTE A BASE DE SILICATO DE ETILO Y POLISILOXANOS OLIGOMÉRICOS
- ESTEL 1200 - CONSOLIDANTE A BASE DE SILICATO DE ETILO CON ACCIÓN PREVENTIVA
- FLUOLINE CP (EX FLUORMET CP)
- NANO ESTEL - CONSOLIDANTE A BASE DE NANOSÍLICE
- NANORESTORE® - CONSOLIDANTE A BASE DE NANOCALES
- POLIETILENGLICOL (PEG) 4000
- POLIETILENGLICOL (PEG) 1500
- POLIETILENGLICOL (PEG) 400
- POLIETILENGLICOL (PEG) 200
- REXIL - CONSOLIDANTE PARA MADERA
- AMONIO FOSFATO DIBASICO
- NANORESTORE PLUS® ETHANOL 10 (Env. 1 lt)
- NANORESTORE PLUS® TEST KIT
-
Protectores - Hidrofugantes
- ART SHIELD 1 - ANTIGRAFFITI
- ART SHIELD 4 - QUITA GRAFFITI
- ÁCIDO TÁNICO AL AGUA
- BENZOTRIAZOL
- CERA MICROCRISTALINA
- CERA RESWAX WH
- WH 10
- FERTAN®
- FLUOLINE HY - PROTECTOR REAGREGANTE
- FLUOLINE ST - LIGANTE PARA ESTUCADOS
- INCRAL 44
- SILO 111 - HIDROFUGANTE A BASE DE ORGANOSILOXANO OLIGOMÉRICO EN DISOLVENTE
- NANO SILO OR
- SILO 112 - HIDROFUGANTE A BASE DE ORGANOSILOXANO OLIGOMÉRICO EN AGUA
- AMONIO OXALATO
- NANO SILO W - HIDROFUGANTE A BASE DE NANOPARTÍCULAS DE SÍLICE FUNCIONALIZADA EN AGUA
-
Morteros y Ligantes
- MORTERO ST.ONE ORIGINAL (EX. HARRITE)
- CAL APAGADA (CAL EN PASTA)
- CAL NATURAL SAINT-ASTIER (NHL 3,5® Y NHL 5®)
- CAL LAFARGE
- MALTAMIX TG
- MALTAMIX TM
- MORTERO PLM - A
- MORTERO PLM - AL
- MORTERO PLM - I
- MORTERO PLM - M
- MORTERO PLM - S
- MORTERO PLM - SM
- PUNTO CAL
- TEMPLUM EPO TOP (PRODUCTO BICOMPONENTE)
- TEMPLUM ESTUCO® (PRODUCTO BICOMPONENTE)
-
Disolvente/Espesante/Geles de sílice
- ACETONA
- ACIDO CITRICO 99,5%
- AGARART
- AGUA DESMINERALIZADA
- ALCOHOL BENCÍLICO
- ALCOHOL ESPECIAL FDN 90/10
- ALCOHOL ISOPROPILICO PURO
- ART SORB® - SILICA GEL (40%-55%)
- BORAX
- BUTIL ACETATO
- BUTILAMINA 99%
- CALCIO HIDRÓXIDO
- CARBOGEL
- CARBOPOL ULTREZ® 21
- CICLOHEXANO DESNATURALIZADO
- CICLOMETICONE D5
- DECON 90 (AGENTE LIMPIADOR CONCENTRADO)
- DIMETILCARBONATO
- DIMETILFORMAMIDA (DMF)
- DIMETILSULFOXIDO (DMSO)
- DISOLVENTE DBE
- DISOLVENTE NITRO PURO ANTIVELO
- DOWANOL® PM (METOXIPROPANOL)
- ESENCIA DE PETROLEO DESNATURALIZADO
- ESENCIA DE TREMENTINA PURA
- ETHOMEEN® C12
- ETHOMEEN® C25
- ETIL ACETATO
- ETIL CELULOSA N 300
- ETIL L-LACTATO
- GEL DE SÍLICE BLANCO SIN INDICADOR
- GEL DE SÍLICE CON INDICADOR AMARILLO
- GELLANO KELCOGEL®
- LIGROÍNA
- MENTOL NATURAL
- METILETILCETONA (MEK)
- NANORESTORE GEL® KIT DE PRUEBA
- NANORESTORE GEL® PEGGY 5
- NANORESTORE GEL® PEGGY 6
- NANORESTORE GEL® PEGGY 5 GUM
- NANORESTORE GEL® PEGGY 6 GUM
- NEVEK®
- PEMULEN® TR2
- PROPILEN CARBONATO
- SHELLSOL® A
- SHELLSOL® D40
- SHELLSOL® T
- TOLUENO
- VANZAN® NF-C
- WHITE SPIRIT D40
- XILENO
-
Reactivos para Laboratorios
- ACETONA - REACTIVO
- ÁCIDO ABIÉTICO - REACTIVO
- ÁCIDO ACÉTICO GLACIAL - REACTIVO
- ÁCIDO CLORHÍDRICO 37% - REACTIVO (ENV.1 L)
- ÁCIDO DEOXICÓLICO - REACTIVO
- ÁCIDO FLUORHÍDRICO 40% - REACTIVO
- ÁCIDO FÓRMICO 85%- REACTIVO
- ÁCIDO FOSFÓRICO 85% - REACTIVO
- ÁCIDO OXÁLICO - REACTIVO
- ÁCIDO TÁNICO - REACTIVO
- ALCOHOL BENCÍLICO - REACTIVO
- ALCOHOL ISOPROPILICO REACTIVO
- AMONIACO 30% - REACTIVO
- AMONIO CITRATO DIBASICO REACTIVO
- AMT.
- BARIO HIDRATO (HIDRÓXIDO DE BARIO) - REACTIVO
- BIS TRIS REACTIVO
- BRIJ 30 (L4) REACTIVO
- BRIJ 35 (L23) REACTIVO
- CALCIO HIDRÓXIDO - REACTIVO
- DIACETONA ALCOHOL - REACTIVO
- DIMETILFORMAMIDA - REACTIVO
- DTPA - REACTIVO
- ETANOL 96º REACTIVO
- ETANOL ABSOLUTO REACTIVO
- ÉTER DE PETRÓLEO 40°-60°C - REACTIVO
- ÉTER ETÍLICO - REACTIVO
- ETIL FORMIATO - REACTIVO
- ISO OCTANO - REACTIVO
- LIGROÍNA 100°-140°C - REACTIVO
- N-METIL-2-PIRROLIDONE - REACTIVO
- NITRATO DE PLATA REACTIVO
- SODIO CARBONATO REACTIVO
- SODIO HIDRATO 32% - REACTIVO
- SODIO HIDROXIDO - REACTIVO
- TOLUENO - REACTIVO
- TRIAMONIO CITRATO REACTIVO
- TRIS REACTIVO
- TRIZMA BASE REACTIVO
- WHITE SPIRIT REACTIVO
- XILENO - REACTIVO
-
Reactivos (para Limpieza por Papetas)
- NEVEK AB57
- NANORESTORE CLEANING® TEST KIT
- NANORESTORE CLEANING® POLAR COATING G
- AMONÍACO (AMONIO HIDRÓXIDO)
- B.D.G. 86
- AMONIO BICARBONATO
- AMONIO CARBONATO
- AMONIO CITRATO TRIBASICO (TAC)
- C 2000
- EDTA SAL BISÓDICA
- EDTA SAL TETRASÓDICA
- EMULSIÓN CEROSA CTS
- HEXAMETAFOSFATO DE SODIO
- IONEX H
- IONEX OH
- NEW DES 50
- PREPARACIÓN ENZIMÁTICA - AMILASA
- PREPARACIÓN ENZIMÁTICA - LIPASA
- PREPARACIONES ENZIMÁTICAS - MIX ENZIMAS
- SAL DE ROCHELLE
- SALIVA SINTÉTICA CTS (SSC)
- SODIO BICARBONATO
- TRIETANOLAMINA 99%
- TWEEN 20
- Cargas (para Limpieza por Papetas)
- Colas, Aditivos y Cargas (para Superficies Pintadas)
- Línea Gustav Berger (para Superficies Pintadas)
-
Telas, Film Poliester y Tejido No Tejido (para Superficies Pintadas)
- FILM POLIÉSTER ART. 23/1 MONOSILICONADO
- PAPEL BISILICONADO ART. BS 80 - 80 GR/M²
- PAPEL BISILICONADO ART. BS120 - 120GR/M²
- PAPEL MONOSILICONADO ART. MS 80 - 80 GR/M²
- PAPEL MONOSILICONADO ART. MS120 - 120GR/M²
- TEJIDO MONOHILADO ART. ORIGAM 254
- TEJIDO NO TEJIDO REEMAY
- TEJIDO NO TEJIDO ART. TNT 30/B
- TEJIDO NO TEJIDO ART. TNT 440
- TEJIDO NO TEJIDO ART. TNT 460
- TEJIDO NO TEJIDO ART. TNT 54
- TEJIDO NO TEJIDO ART. TNT 55
- TEJIDO NO TEJIDO ART. TNT 84
- TELA ART. CTS 1111 - LINO HERVIDO
- TELA ART. CTS 2139 – 100% LINO
- TELA ART. CTS 2297 – 100% LINO
- TELA PATTA 100% LINO
- TELA PATTINA 100% LINO
- TELA SINTÉTICA TREVIRA DELAY - BLANCA
- TELA SINTÉTICA TREVIRA ISPRA
- TELA SINTÉTICA TREVIRA LIPARI
- TELA CRINOLINA EN ALGODÓN
- TELA VELADINA DE ALGODÓN
- VELO DE LYON (CREPELINA)
- TISU BLANCO
- Decapantes
- Tratamientos para madera antixilófagos
- Conservantes para materiales de construcción
- Aditivos Deshumidificadores
- Gomas Siliconas para Moldes
- Estucado, Sellado y Acabados Varios
-
Colores
- PUREST+ COLORES DE RETOQUE EXTRA PUROs
- GODET ACUARELAS W&N EXTRAFINAS PARA ARTISTAS
- TUBO 5 ML - ACUARELAS W&N EXTRAFINAS PARA ARTISTAS
- ACUARELAS W&N EXTRAFINAS PARA ARTISTAS - TUBOS DE 14 ML
- CAJA ACUARELA W&N ART.553 24 MEDIO GODET
- MAIMERI “RESTAURO” COLORES AL BARNIZ
- “MAIMERI GOAUCHE” COLORES AL TEMPLE EXTRAFINOS
- COLORES CERÁMICA EN FRÍO “CERAMIC” LEFRANC & BOURGEOIS
- GAMBLIN COLORES CONSERVACIÓN - TARRITOS DE CRISTAL DE 15 ML
- PIGMENTOS PUROS CTS PARA ARTISTAS
- COLORES PERLADOS ORO Y PLATA COLIRO
-
Pinceles
- PINCEL PLANO SERIE 122 DV
- PINCEL DE RETOQUE SERIE 10 DV MAESTRO
- PINCELES DE LENGUA DE GATO SERIE 83/C
- BROCHA SERIE 11245
- BROCHA SERIE CTS 310
- BROCHA SERIE CTS 522
- PINCELES DE RETOQUE CTS 304
- PINCELES DE RETOQUE SERIE 1570
- PINCELES ESTRANGULADO SERIE 311
- PINCELES PLANO SERIE 571
- PINCELES PLANO SERIE 579
- PINCELES REDONDO DE MARTA CTS SERIE 303
- PINCELES REDONDO SERIE 582
- PINCELES REGLA SERIE 124
- PINCELES SERIE 7 MINIATURE W&N
- PINCELES SERIE 7 W&N (MARTA KOLINSKY)
- PINCEL DE RETOQUE SERIE 107 CTS - MARTA KOLINSKY
- JABON VEGETAL PARA PINCELES
- PINCELES PLANO SERIE 371
- PINCELES DE RADIADOR
- PINCELES DE TRAZO
- PINCELES MUCCINO
- PINCELES BOMBASINO
- BROCHA SERIE 303
- PINCELES PARA ESTARCIR - SERIE 111
-
Barnices, aceites, esencias, etc.
- ACEITE DE AMAPOLA ART. 656 MAIMERI
- ACEITE DE LINAZA ART. 650 MAIMERI
- ACEITE DE NUEZ ART. 654 MAIMERI
- BARNICES FINALES BRILLANTES ART. 002 TALENS
- BARNICES FINALES BRILLANTES ART. 081 TALENS
- BARNICES FINALES BRILLANTES ART. 114 TALENS
- BARNICES FINALES BRILLANTES ART. 1186 L&B
- BARNICES FINALES BRILLANTES ART. 1251 L&B
- BARNICES FINALES BRILLANTES ART. 1826 L&B
- BARNICES FINALES BRILLANTES ART. REGAL VARNISH GLOSS
- BARNICES FINALES BRILLANTES ART. REGAL VARNISH DAMMAR
- BARNICES FINALES MATES ART. 003 TALENS
- BARNICES FINALES MATES ART. 082 TALENS
- BARNICES FINALES MATES ART. 115 TALENS
- BARNICES FINALES MATES ART. 159 L&B
- BARNICES FINALES MATES ART. 811 L&B
- BARNICES FINALES MATES ART. 828 L&B
- BARNICES FINALES MATES ART. REGAL VARNISH MAT
- BARNICES PARA RETOQUE ART. 004 TALENS
- BARNICES PARA RETOQUE ART. 1825 L&B
- BARNICES PARA RETOQUE ART. REGAL RETOUCHING VARNISH
- ESENCIA DE ÁSPIC ART. 882 L&B
- ESENCIA DE PETRÓLEO ART. 1247 L&B
- ESENCIA DE TREMENTINA ART. 1181 L&B
- BARNIZ DE RETOQUE J.G. VIBERT ART. 1253 L&B
- BARNIZ DE RETOQUE EXTRAFINO ART. 1188 L&B
- BARNIZ SATINADO ART.167 L&B (SPRAY)
-
Papeles, Cartones, etc.
- BOOKKEEPER®
- ETHAFOAM
- FILMOPLAST® P
- FILMOPLAST® P90
- FILMOPLAST® R
- FILMOPLAST® SH
- FILMOPLAST® T
- NANORESTORE PAPER® ETHANOL 3
- PAPEL JAPONÉS 22 GR - ART. 161 KINUGAWA
- PAPEL JAPONÉS 29 GR - ART. 221 KAWANAKA
- PAPEL JAPONÉS 12 GR - ART. 240 BIB TENGUJO
- PAPEL JAPONÉS 9 GR - ART. 502 TENGUJO KASHMIR
- PAPEL JAPONÉS 18 GR - ART. 508 TENGUJO
- PAPEL JAPONÉS 6 GR - ART. 561 TENGUJO
- PAPEL JAPONÉS 43 GR - ART. 781 TAKOGAMI
- PAPEL JAPONÉS BOLLORÉ - 12,3 G/M²
- PAPEL JAPONÉS BOLLORÉ - 22 g/m²
- PAPEL FILTRO SECANTE DE LABORATORIO
- PAPEL SECANTE
- PLASTAZOTE™
-
Productos para el Dorado
- ALMOHADILLA PARA DORADORES
- BARNIZ MECA (DE CORLADURA)
- BETÚN LÍQUIDO (DE JUDEA)
- BOL ARMÉNICO
- BOL PARA DORAR CHARBONNEL L&B
- BRUÑIDORES DE AGATA
- CERA PARA DORAR
- CUCHILLO PARA DORADORES
- DORADO LÍQUIDO
- MIXTIÓN AL AGUA CHARBONNEL L&B
- MIXTIÓN AL AGUA PARA DORAR
- MIXTIÓN PARA DORAR 12 H CHARBONNEL L&B
- MIXTIÓN PARA DORAR 3 H CHARBONNEL L&B
- ORO AUTÉNTICO EN PASTILLA 23 3/4K GODET (CONCHA)
- ORO AUTÉNTICO EN HOJAS 22K
- ORO AUTÉNTICO EN HOJAS 23 3/4K
- ORO AUTÉNTICO EN POLVO 23 3/4K
- ORO FALSO EN HOJAS DIM. 16X16 CM
- PLATA AUTÉNTICA DECALCO EN HOJAS
- PLATA AUTÉNTICA EN HOJAS
- PLATA AUTÉNTICA EN POLVO
- PLATA FALSA EN HOJAS
- POLONESA SERIE 500
- IRIODIN
-
Accesorios para Bellas Artes
- CABALLETE DE ESTUDIO ART. M04 CON MANIVELA
- CABALLETE DE ESTUDIO ART. M05 CON MANIVELA
- CABALLETE DE ESTUDIO ART. M06
- CABALLETE DE ESTUDIO ART. M07
- CABALLETE DE ESTUDIO ART. M09
- CABALLETE DE ESTUDIO ART. M10
- CABALLETE DE ESTUDIO ART. M18 ABATIBLE
- CABALLETE DE ESTUDIO ART. 2400
- CABALLETE DE MESA ART. M14
- CABALLETE DE MESA ART. M17
- LAVAPINCELES ART. 715 (EX 3730)
- PALETA OVALADA DE MADERA ART. 014
- PALETA RECTANGULAR CON TAPA
- PALETA RECTANGULAR ART. 2179
- PALETA RECTANGULAR DE MADERA ART. 003
- PALETA RECTANGULAR EN FORMICA ART. F1
- PALETA RECTANGULAR EN PLÁSTICO ART. 006
- PALETA RECTANGULAR EN PLEXIGLAS ART. P2
- PALETA EN PORCELANA RECTANGULAR CON TAPA
- SALSERILLA DE CHAPA
- SALSERILLA DE PLÁSTICO
- SALSERILLA EN LATÓN NIQUELADO
- TIENTO ART. 020
-
Herramientas y minuterías variadas
- AGUJAS DE ACERO INOX
- AGUJAS ESTRANGULADAS COLOREADAS
- ALFOMBRILLA PARA CORTE
- BARRITA DE FIBRA DE VIDRIO
- BISTURI CUCHILLA FIJA GRANDE
- BISTURI CUCHILLA FIJA PEQUEÑA
- BOBINA DE PAPEL & CABALLETE PORTABOBINAS
- BROQUETAS DE BAMBÚ
- CEDAZO DE ACERO INOXIDABLE
- CEDAZO DE MADERA
- CEPILLO - CERDA Y ACERO ART. 204 RA
- CEPILLO - CERDA Y LATÓN ART. 204 RO
- CEPILLO EN LATÓN ART. 3184
- CEPILLO DE DIENTES
- CEPILLO DE RAÍZ OVAL ART. 161
- CEPILLO DE RAÍZ OVAL ART. 170
- CEPILLO DE UÑAS ART. 351
- CEPILLO EN FIBRA SINTÉTICA ART. 161/S
- CEPILLO EN FIBRA SINTÉTICA ART. 180
- CEPILLO EN NYLON BLANCO ART. 3182
- CEPILLO RN EN NYLON ART. 204
- CEPILLO DE "COPA"
- CEPILLOS DE "PINCEL"
- CEPILLOS DE “DISCO”
- CEPILLO SLIM EN ACERO INOX.
- CEPILLO SLIM EN NAYLON VERDE
- CINCEL DE PUNTA DE WIDIA
- CORTADOR PARA MOSAICO DE ACERO
- CUCHILLA PARA BISTURI
- CUCHILLAS Y MANGOS PARA BISTURÍ “SWANN-MORTON”
- CUCHILLO DE LAMA CURVA ART. T1
- CUTTER DE PRECISIÓN
- CUTTER GRANDE ART. 118
- CUTTER PEQUEÑO ART. 014
- ESCUADRA
- ESCUDILLA FLEXIBLE
- ESPÁTULA ART. 101 FE
- ESPÁTULA ART. 7655
- ESPÁTULA DE ACERO INOX
- ESPÁTULA DENTADA ART. 111
- ESPÁTULA DOBLE HOJA
- ESPÁTULA EN ACERO AL CARBONO TEMPLADO
- ESPÁTULA HOJA FLEXIBLE Y LANZA CURVA RÍGIDA
- ESPÁTULA HOJA FLEXIBLE Y PALETA RÍGIDA
- ESPONJA ART SPONGE
- ESPONJA NATURAL
- ESPONJA SINTÉTICA SÚPER ABSORBENTE
- ESPONJA SPONTEX®
- ESPONJA WISHAB (AKAPAD)
- EXPLORADOR DENTAL EN ACERO INOX
- FISURÍMETRO PLEGABLE DE DOBLE ESCALA
- FRATÁS ART. 313
- FRESAS DE CARBORUNDUM ROSA PARA MICROMOTORES
- FRESAS EN ACERO PARA MICROMOTORES
- FRESAS EN CARBURO DE TUNGSTENO
- FRESAS EN GOMA PARA MICROMOTORES
- GOMA PAN ART. 6255000
- GUBIAS PARA MADERA
- HYPERASER ZE 32
- JERINGA DE LATÓN
- JERINGA DE PLÁSTICO
- JERINGA DE PLÁSTICO CON AGUJA
- JERINGA DE PLÁSTICO CON ÉMBOLO DE TEFLON
- JERINGA DE VIDRIO
- LANA DE ACERO
- LÁPIZ ABRASIVO "THOMAS"
- LUPA CUENTAHILOS Y LENTE DE MONÓCULO
- MANGOS DE BISTURÍ DE ACERO INOX
- MARTELINA
- MERETAS DE HILO CORTANTE
- PALETINA
- PALITOS DEPRESORES EN MADERA
- PAPEL DE LIJA ART. 612 EN ROLLO Y TACO DE GOMA
- PAPEL DE LIJA ART. 613 EN HOJAS
- PAPEL DE LIJA ART. 633 EN HOJAS
- PAPEL ENGOMADO
- PAPEL INDICADOR de pH
- PERFILÓMETRO
- PIEDRA PARA AFILAR
- PINCEL AQUASH
- PINZA DE TIJERA EN ACERO INOX
- PINZAS EN ACERO INOX
- PIPETA CUENTAGOTAS GRADUADA DE 3 ML (CAJA DE 100 UD) DE PLÁSTICO
- PIQUETA PARA MOSAICO
- PUNTA PARA TRAZAR ART. 016
- REGLA SEMIRIGIDA
- RIFLOIRS DOBLE ESCOFINA
- RIFLOIRS DOBLE LIMA
- RIFLOIRS LIMA ESCOFINA
- ROLLO DE ALUMINIO
- ROLLO PELÍCULA TRASPARENTE
- ROLLO SCOTCH HABANA
- ROLLO SCOTCH PAPEL
- ROLLO CINTA AMERICANA GRIS
- TABLILLA DE BOJ ART. 8051
- TABLILLA DE HUESO DE DOBLE PUNTA
- TABLILLA DE TEFLÓN
- TALADRO MANUAL
- TENAZA PARA MOSAICO CON CORTE DE WIDIA
- TIJERAS
- WISHAB EN POLVO (AKAWIPE)
-
Contenedores
- BEKER GRADUADO EN POLIPROPILENO
- BEKER GRADUADO EN VIDRIO
- BIDÓN EN POLIETILENO
- BOTE REDONDO
- BOTELLA BOCA ANCHA
- BOTELLA DE VIDRIO AMARILLO
- BOTELLA RECTANGULAR
- BOTELLÓN CON GRIFO
- BOTELLÓN CON TAPÓN DE ROSCA
- CILINDRO GRADUADO EN POLIPROPILENO
- CILINDRO GRADUADO EN VIDRIO
- CONTENEDOR PORTA MUESTRAS
- CUBETA ANTIÁCIDO
- CUBETA APILABLE CON TAPA
- CUBETA DE PVC
- CUBETA RECTANGULAR ART. 548
- CUBETA SOBREPONIBLE
- CUBO
- CUCHARA EN POLIETILENO
- ECOSPRAY®
- EMBUDO
- FRASCO DE LAVADO EN POLIETILENO
- JARRÓN GRADUADO
- PULVERIZADOR
- BOTE DISPENSADOR
-
Seguridad
- CASCO PROTECTOR
- GUANTES ANTIÁCIDO-ANTIDISOLVENTE NEOPRENO NEGRO
- GUANTES ANTIÁCIDO-ANTIDISOLVENTES NITRILO VERDE
- GUANTES EN LÁTEX DE GOMA AMARILLA
- GUANTES DE ALGODÓN PARA ARCHIVO
- GUANTES “CIRUJANO” DE LÁTEX
- GUANTES “CIRUJANO” DE NITRILO
- CAPUCHA DE TYVEK CON TRES ORIFICIOS
- FILTRO 3M (CLASES A1-K1-ABEK1)
- FILTRO 3M PARA POLVOS Y RETENEDOR
- MÁSCARAS SERIE 6000 3M
- MASCARILLAS PARA POLVO "SERIE 9300+" CON Y SIN VÁLVULA
- MASCARILLA 3 M ART. 4279+
- MASCARILLA 3M ART. 4251+
- MASCARILLA ORGANICOS 3M ART. 9913 (20PZ)
- MASCARILLA DE POLVO SIN VALVULA
- BATA BLANCA DE ALGODÓN
- MONO BLANCO DE ALGODÓN
- MONO DE TYVEK CON CAPUCHA
- MONO DE TYVEK CON ESPALDA TRANSPIRANTE
- PETO BLANCO DE ALGODÓN
- VISERA BINOCULAR MOD. OPTI VISOR®
- VISIERA ECO VISOR CON LUZ INTEGRADA Y 5 LENTES DE AUMENTO
- GAFAS PROTECTORAS DE PANTALLA FIJA
- GAFA 3M ART. G2890 VAPORES
- GAFAS PROTECTORAS CON PATILLAS ART. ET 81BS
-
Equipos para la Forración
- ESPATULA CALIENTE PARA SUTURA
- ESPÁTULA CALIENTE CTS ARTIST III Y PUNTAS DE RECAMBIO
- BAÑO-MARIA DE ALUMINIO
- CALIENTA CERA MOD.W01
- CALIENTA COLA MOD. RCBM
- GRAPADORA
- MARTILLO MAGNÉTICO ART. 389
- PINZA TENSATELAS ART. 030
- PINZAS TENSATELAS CTS
- PLANCHA CON PLACA DE 5,3 KG
- PLANCHA DE 3,2 KG FIJA Y PLACA JUST
- TACHUELAS (CLAVOS ANTIOXIDO)
- TELAR MECÁNICO
- FLEJES
-
Equipos para la Limpieza
-
Instrumentos Aeroabrasivos
- MINIABRASIMETRO CTS ART 100 BASE
- MINIHIDROABRASIMETRO CTS ART 100
- MINIABRASIMETRO CTS ART 100 MINI
- BOQUILLA DE WIDIA PARA MICROABRASÍMETRO
- BOQUILLA DE WIDIA PARA MINIHIDROABRASÍMETRO
- BOQUILLA DE WIDIA PARA MINIPISTOLA
- BOX CTS 4
- FILTROS DESHUMIDIFICADORES
- MICROABRASÍMETRO CTS 1
- MICROABRASÍMETRO CTS 2
- MICROABRASÍMETRO CTS 5
- MICROESFERAS DE VIDRIO
- MICROHIDROABRASÍMETRO CTS 6
- MINIPISTOLAS SERIE CTS 10
- ÓXIDO DE ALUMINIO BLANCO
- PÓMEZ
- TUBO ESPIRAL
- Limpieza Mecánica
- Limpieza de Ultrasonidos
- Limpieza Física
-
Instrumentos Aeroabrasivos
-
Lámparas
- LÁMPARA CTS ART LUX 10
- LÁMPARA CTS ART LUX 100L NEW
- LÁMPARA CTS ART LUX 200L NEW
- LÁMPARA CTS ART LUX 200LW NEW
- LÁMPARA CTS ART LUX 100LW NEW
- LINTERNA UV LED PROFESIONAL 365 nm
- ACCESORIOS PARA LÁMPARAS CTS ART LUX 10 - 20L - 30 - 40 - 50LW
- ACCESORIOS Y SOPORTES PARA LAS LÁMPARAS CTS ART LUX 4 - 5 - 100L - 100LW - 200L
- BOMBILLA IR 250
- BOMBILLA PAR 38
- BOMBILLA W 160 DE LUZ DE WOOD
- LÁMPARA CTS ART LUX 20 L
- LÁMPARA CTS ART LUX 50LW
-
Instrumentos para Medición y Detección
- DATA LOGGER HOBO MOD. UX 100-003
- HOBOWare_SOFTWARE de analisis para DATA LOGGER HOBO
- DATA LOGGER HOBO BLUETOOTH MOD. MX 1101
- DATA LOGGER MOD. EL-USB-2
- DATA LOGGER MOD. EL-USB-2 LCD
- DATA LOGGER MOD. EL-WIFI-TH
- BALANZA ELECTRÓNICA MOD. NVT OHAUS
- BALANZA ELECTRÓNICA MOD. NV 622 OHAUS
- BALANZA ELECTRÓNICA MOD.PR 523/E OHAUS
- BALANZA ELECTRÓNICA MOD.PR 4202/E OHAUS
- BALANZA ELECTRÓNICA MOD. V12P30 OHAUS
- BALANZA ELECTRÓNICA MOD. CX 1201 OHAUS
- BALANZAS ELECTRÓNICAS MOD. CR OHAUS (CR 621-CR 2200-CR 5200)
- CONDUCTIVÍMETRO MOD. HI 8633
- CONDUCTIVÍMETRO HI 99301
- CONDUCTIVÍMETRO MOD. COND 1
- EQUIPO DE REFLECTOGRAFÍA MOD. MIR 10 NEW
- ESPONJA DE CONTACTO - KIT
- HIGRÓMETRO MOD. 7825 PS
- HIGRÓMETRO MOD. HUMYTESTER 993TC / 993 B
- LUXÓMETRO MOD. 1330B
- PHMETRO - CONDUCTIVÍMETRO - TERMÓMETRO MOD. COMBO
- PHMETRO MOD. PHEP 4
- PHMETRO MOD. PICCOLO
- PHMETRO MOD. CHECKER
- TERMOHIGRÓGRAFO
- TERMOHIGRÓMETRO MOD. 6835
- TERMÓMETRO MOD. 652 DE INFRARROJOS
- TERMÓMETRO MOD. CHECKTEMP 1C
- TESTING PEN - LÁPIZ TESTER
- INDICADOR DE OXIGENO OXY-EYE
- PHMETRO MOD. HI 9810442
-
Compresores
- COMPRESOR CARRELADO AB 300-678 (ex AB 300-670)
- COMPRESOR CARRELADO MOD. COSMOS 225
- COMPRESOR CARRELADO MOD. 3650 (EX VX 50-304)
- COMPRESOR PORTÁTIL MOD. ECU 201
- COMPRESOR SILENCIADO MOD. 25/100
- COMPRESOR SILENCIADO MOD. 50/150
- COMPRESOR SILENCIADO MOD. AIR BAG
- COMPRESOR SILENCIADO MOD. N.W. AB360
- COMPRESORES SILENCIADOS MOD. SO 43/85-200
- COMPRESORES SILENCIADOS MOD. SO 52/105-300
- COMPRESORES SILENCIADOS MOD. SO 60/110-500
- MOTO COMPRESOR MOD. AGRI 90/670
- COMPRESOR CARRELADO MOD. ABAC 5,5 Hp
- Sistemas y Equipos para el Vacío
- Equipos Desmineralizadores
-
Equipos para Papel y Encuadernación
- CORTADORA PASSEPARTOUT LOGAN SIMPLEX ELITE 760-1
- CÁMARA DE HUMIDIFICACIÓN
- CLASIFICADORES HORIZONTALES SERIE M200E
- CORDÓN DE CÁÑAMO
- CORTACARTÓN MOD. TCT 1100
- CUCHILLO PARA DESCARNAR
- CUCHILLO PARA DESCARNAR ART. 12/19
- EJES PARA LOMOS
- GUILLOTINA MOD. L450
- GUILLOTINA MOD. M9000
- HILO DE LINO PURO 100%
- INSTALACIÓN DE DESACIDIFICACIÓN
- MARTILLO PARA ENDOSAR
- MESA DE BAJA PRESIÓN MOD. NSD 11
- MESA LUMINOSA SERIE ARQUITECTO
- MESA LUMINOSA SERIE RACK
- MESAS
- MESAS CON PERFIL DE COBRE PARA MÉTODO “BRADEL”
- MESAS DE BAJA PRESIÓN MOD. NSD 110 - 115
- MESAS DE BAJA PRESIÓN SERIE NSD 1100 - 1101 - 1120
- MICRÓMETRO ART. 8610
- PESOS
- PRENSA DE MADERA ART. 1/15
- PRENSA DE MADERA ART. 3/15
- PRENSA DE MADERA ART. 4/16
- PRENSA PARA LOMOS ART. 1/11 “DANTON JUNIOR”
- PRENSA PARA LOMOS ART. 1/12 “DANTON AMATEUR”
- PRENSAS DE IMPACTO MOD. PC 4050
- PRENSAS DE IMPACTO MOD. PC 5070
- PUNTERO ART. 7/18
- SECADEROS “COMPACTO” MOD. A
- SECADEROS “COMPACTO” MOD. B
- SECADEROS “COMPACTO” MOD. C
- SECADEROS “COMPACTO” MOD. D
- SOPORTE EXTENSIBLE ART. 10/15
- SOPORTE PARA CURVATURAS DE LOS LOMOS
- TELAR DE MADERA PARA COSTURA
- TÓRCULOS
- TROQUELADORA
- MESA DE SUCCIÓN PARA DESEMPOLVADO MOD. CTS BOX T
- MESA DE BAJA PRESIÓN CTS ART BOOK
- MICROMETRO ART. 0310
-
Equipos Auxiliares
- ABSORBEDORES DE OXIGENO ATCO 1000
- ASPIRADOR - ASPIRA LIQUIDOS MOD. 440 MARKET (EX 433)
- ASPIRADOR - ASPIRA LIQUIDOS MOD.215 (EX 315 BASE)
- ASPIRADOR MOD. LP 1/12 LUXE
- ASPIRADOR-SOPLADOR PORTATIL MOD. MUSEUM MUNTZ 555-MU-E HEPA NEW
- ASPIRADORES - ASPIRA LIQUIDOS MOD. 429 MARKET
- ASPIRADOR DE MOCHILA MOD. YP 1/5 BACKPACK
- BATIDORES DE DOBLE HÉLICE
- CINTA SELLADORA BUTILICA
- EQUIPO DE DESINFESTACIÓN MOD.CTS ANOXI 24 EN ATMÓSFERA CONTROLADA
- INDICADOR DE OXIGENO OXY-EYE
- MICRO KIT MENALUX (PARA TODAS LAS ASPIRADORAS)
- MICRO SOPLADOR DE AIRE MOD. RT500
- MICROSOLDADORES
- PISTOLA CON DEPÓSITO SUPERIOR DE NYLON
- PULVERIZADOR A PRESIÓN MOD. 1922 DE 23 L.
- PULVERIZADOR A PRESIÓN MOD. ALTA 7000 DE 6 L.
- SOPLADOR DE AIRE CALIENTE MOD. MP 300 E
-
Equipos para Laboratorio
- AGITADOR MAGNÉTICO MOD. M2-A
- AGITADORES MECANICOS
- ARMARIO DE SEGURIDAD "CHEMISAFE FIRE" MY23 60 BASIC
- ARMARIO DE SEGURIDAD "CHEMISAFE FIRE" MY23 90 BASIC
- ARMARIO DE SEGURIDAD "CHEMISAFE FIRE" MY23 120 BASIC
- ARMARIO DE SEGURIDAD "CHEMISAFE FIRE COMBISTORAGE UNDERBENCH" SAFETYFARECASE
- ARMARIO DE SEGURIDAD "CHEMISAFE FIRE COMBISTORAGE UNDERBENCH” 60 UB
- ARMARIO DE SEGURIDAD "CHEMISAFE FIRE COMBISTORAGE UNDERBENCH” 120 UB
- ARMARIO DE SEGURIDAD "CHEMISAFE CHEMICALS" 60
- ARMARIOS DE SEGURIDAD "CHEMISAFE CHEMICALS" 120
- ARMARIOS DE SEGURIDAD "CHEMISAFE CHEMICALS" 60 A+B
- ARMARIO DE SEGURIDAD "CHEMISAFE COMBISTORAGE UNDERBENCH" 60 UB
- ARMARIO DE SEGURIDAD "CHEMISAFE VELENI"
- BANCO CAMPANA EXTRACTORA ASEM - SERIE CP CLASE 0
- BANCO CAMPANA ESTRACTORA ASEM - SERIE CP CLASE 1
- SISTEMA DE ASPIRACIÓN/FILTRACIÓN MOLECULAR tipo CFN_UB
- SISTEMA DE ASPIRACIÓN/FILTRACIÓN MOLECULAR tipo CFN
- UNIDAD FILTRO-ASPIRANTE MOD. IC 100 NEW
- GRUPO FILTRO ASPIRADO PORTÁTIL CTS 201
- CAMPANAS MOD. CHEMIHOOD 60-120 PLUS CON FILTRACIÓN
- HUMIDIFICADOR PORTATIL MOD. B-260
- HUMIDIFICATORE PORTÁTIL MOD. B600
- BARRA MAGNÉTICA
- CAMPANA MOD. ASEM NEW ICP 120EN - CLASE 0
- CAMPANAS MODELO CHEMIHOOD 60-120 ASPIRADAS Y FILTRADAS
- CARRO DE LABORATORIO ART. 101.104
- CARRO DE LABORATORIO ART. 2401
- CARRO DE LABORATORIO ART. 713
- CARRO PARA LABORATORIO ART. B33
- DESHUMIDIFICADOR MOD. FDC 32
- DESHUMIDIFICADOR MOD. FDNF 44
- ESTUFA TERMOSTÁTICA MOD. TCN 50 PLUS
- ESTUFA TERMOSTÁTICA MOD. TCN 115 PLUS
- ESTUFA TERMOSTÁTICA MOD. TCN 200 PLUS
- ESTUFA TERMOSTÁTICA MOD. TCF 400 PLUS
- FILTRO MOD. K CLEAN 6S
- GRUPO CARRELADO FILTRO-ASPIRANTE MOD. CTS 1B - 2B PLUS
- GRUPO CARRELADO FILTRO-ASPIRANTE MOD. CTS 1B COMPACT
- GRUPO FIJO FILTRO-ASPIRANTE MOD. CTS ICAP NEW
- HORNILLO ELÉCTRICO MOD. K 19
- PLANCHA ELÉCTRICA ART. 3400
- TABURETE DE LABORATORIO ART. 331
- TORNETE DE PEDESTAL (DIAM. 300 MM.)
- TORNETES CON MOVIMIENTO DE RODAMIENTOS
- AGITADOR MAGNETICO MOD. ST 10
- KIT DE EXPULSION PARA ARMARIOS “CHEMISAFE+FIRE” O CAMPANAS “CAPPE CHEMIHOOD”
-
Microscopios
- VIDEOMICROSCOPIO WIRELESS MOD. WF 4515 ZT
- ACCESORIOS PARA MICROSCOPIOS
- CÁMARA DE VÍDEO DE COLORES MOD. B5
- MANTIS COMPACT
- MICROSCOPIO ESTEREOSCÓPICO MOD. 508 SPOT ZEISS TRIOCULAR
- MICROSCOPIO ESTEREOSCOPICO MOD. SZM-1 TRIOCULAR
- MICROSCOPIO ESTEREOSCÓPICO MOD. SZM-2 TRIOCULAR
- MICROSCOPIO ESTEREOSCÓPICO MOD. SZM-4 TRIOCULAR
- MICROSCOPIO MONOCULAR MOD. XC-100L PORTÁTIL
- MICROSCOPIO STEREOSCOPICO MOD. 305 SPOT ZEISS - BINOCULARE
- VIDEOENDOSCOPIO MOD. 200SD
- VIDEOMICROSCOPIO DIGITAL MOD. AD4113 ZTL
- VIDEOMICROSCOPIO DIGITAL MOD. AM 4113 ZT
- VIDEOMICROSCOPIO DIGITAL MOD.AM4113 T-FVW
- SOPORTES PARA VIDEOMICROSCOPIOS DINO LITE
- MICROSCOPIO ESTEREOSCÓPICO MOD. 508-OPMI ZEISS TRIOCULAR
- SOPORTE MOD. SZ-STL 5 LED PARA MICROSCOPIOS SZM
-
Soportes para Mosaicos y Pinturas Murales
- PANELES DE NIDO DE ABEJA SERIE HPA 1 (EX. PGA) ART.6/12
- PANELES DE NIDO DE ABEJA SERIE HPA 1 (EX. PGA) ART.6/25
- PANELES DE NIDO DE ABEJA SERIE HPA 1 (EX. PGA) ART.6/30
- PANELES DE NIDO DE ABEJA SERIE HPA 2 (EX. PGA) ART.6/12
- PANELES DE NIDO DE ABEJA SERIE HPA 2 (EX. PGA) ART.6/25
- PANELES DE NIDO DE ABEJA SERIE HPA 2 (EX. PGA) ART.6/30
- CONSERVACIÓN Y ARCHIVO CTS
-
CTS FOCUS
- 5º PRÓXIMAMENTE: BEVA 371 AKRON
- 4º NUEVOS COLORES PUREST+: EL BETÚN
- 4º LA VENTAJA DE LAS MICROESFERAS: PROYECTO CO.R.A.VE
- 4º WATER EPO: ¿POR QUÉ UN EPOXI A BASE DE AGUA?
- 3º CTS FOCUS - TEMPLUM STUCCO... PARA LAS REPOSICIONES.
- 3º CTS FOCUS - 40 AÑOS DE FIABILIDAD EN LOS PRODUCTOS CTS
- 3º CTS FOCUS - El BDG se renueva con un tratamiento de estuco
- 2º CTS FOCUS - Restauración conservativa en Lesina y Cattaro
- 2º CTS FOCUS - Restauración in situ: experimento sobre el uso de un producto de siloxano
- 2º CTS FOCUS - Jornada de geles y metales
- 1º CTS FOCUS - Los secretos de Beva ® 371
- 1º CTS FOCUS - Érase una vez Solvesso 100
- 1° CTS FOCUS - El Rosario y las termitas
- 57.3 RESTAURACIONES PARA RECORDAR: ALBERTO BURRI RELOADED Y MÁS ALLÁ
- 57.2 MÁS INFORMACIÓN: ¡OH NO, SE HA DESPEGADO EL ÁNFORA!
- 57.1 NUEVOS PRODUCTOS: DBE, EL DISOLVENTE MÁS ECOLÓGICO
- 56.3 RESTAURACIONES PARA RECORDAR: LA DEPOSICIÓN Y LA FAMILIA FLUOLINE
- 56.2 MÁS INFORMACIÓN: TENDENCIA AL VERDE.
- 56.1 MÁS INFORMACIÓN: INVISIBLE PERO ÚTIL
- 55.1 QUÍMICA E INVESTIGACIÓN - ENSAYOS MICROQUÍMICOS EN PAPEL
- 55.2 QUÍMICA E INVESTIGACIÓN - CUESTIÓN DE PEELING
- 55.3 RESTAURACIONES PARA RECORDAR - CUANDO LOS MAPAS GEOGRÁFICOS TAMBIÉN SON PINTURAS MURALES...
- 54.1 NUEVOS PRODUCTOS - PROTECCIÓN DEL BRONCEO: CTS WH Y EL CASO REDIPUGLIA
- 54.2 NUEVOS PRODUCTOS - LAS PURPURINAS DEL FUTURO: LOS PIGMENTOS MICÁCEOS (IRIODIN)
- 54.3 NUEVOS PRODUCTOS - LA MÁS PEQUEÑA DE LAS CELULOSAS
- 53.1 NUEVOS PRODUCTOS - ESTUDIOS DE EFICIENCIA Y ESTABILIDAD - NANO SILO W
- 53.2 NUEVOS PRODUCTOS - EL PLASMA FRÍO CONTRA LOS VIRUS
- 53.3 NUEVOS PRODUCTOS - UNA INYECCIÓN DE ESTABILIDAD
- 52.1 NUEVOS PRODUCTOS - LA GOMA DAMMAR SE INCLUYE EN LA FAMILIA REGAL
- 51.1 NUEVOS PRODUCTOS - ¡LLEGA EL NUEVO FILM!
- 51.2 NUEVOS PRODUCTOS - EL NANO QUE PROTEGE
- 51.3 MÁS INFORMACIÓN - ¿POLÍMEROS PARA EL ARTE CONTEMPORÁNEO?
- 50.1 MÁS INFORMACIÓN - PROTECTORES HIDROFUGANTES: ¿CUÁNTO DURAN?
- 50.2 MÁS INFORMACIÓN - BEVA, ¡QUÉ PASIÓN!
- 50.3 NUEVOS PRODUCTOS - REGAL VARNISH, ¡FINALMENTE EN SPRAY!
- 50.4 FORMACIÓN E INFORMACIÓN - EL NEVEK Y LAS ESTATUAS DE MADERA
- 49.1 NUEVOS PRODUCTOS - DECK 4000: LA PAREJA DIOXOLANO Y METILAL
- 49.2 MÁS INFORMACIÓN - LA PROTECCIÓN MATE DE LAS PINTURAS MURALES
- 49.3 NUEVOS PRODUCTOS - FUNORI MULTIMATERIAL
- 48.1 QUÍMICA E INVESTIGACIÓN - AGUAS MÁS O MENOS AGITADAS PARA EL AGARART
- 48.2 NUEVOS PRODUCTOS - LA PUREZA DEL FUNORI
- 48.3 NUEVOS PRODUCTOS - LLEGA EL NUEVO TEMPLUM
- 47.1 MÁS INFORMACIÓN - IONEX Y FRA ANGÉLICO
- 47.2 MÁS INFORMACIÓN - REGAL VARNISH: FRA ANGÉLICO, BOTTICELLI Y LOS DEMÁS
- 47.3 MÁS INFORMACIÓN - USAR EL CITRATO DE AMONIO
- 46.1 MÁS INFORMACIÓN - ¡UN MORTERO ALCOHÓLICO!
- 46.2 MÁS INFORMACIÓN - INCRAL 44 SOBRE PLATA
- 46.3 NUEVOS PRODUCTOS - EL PAPEL HANJI EN LA CONSOLIDACIÓN DE FIBRAS VEGETALES
- 45.1 NUEVOS PRODUCTOS - VALIDACIONES Y PRESTIGIOSAS RESTAURACIONES PARA EL PAPEL DE MORERA HANJI
- 45.2 MÁS INFORMACIÓN - COMPRESAS: SEPIOLITA O ARBOCEL?
- 45.3 NUEVOS PRODUCTOS - UN ANTIGUO, NUEVO DISOLVENTE: EL CARBONATO DE PROPILENO
- 45.4 FORMACIÓN E INFORMACIÓN - EL ACRIL ME, ES TODAVÍA MÁS NANO
- 44.1 MÁS INFORMACIÓN - ¡HA VUELTO AQUAZOL!
- 44.2 MÁS INFORMACIÓN - RESINAS VINÍLICAS: SITUACIÓN ACTUAL
- 44.3 MÁS INFORMACIÓN - BALSITE: ARQUEOLOGÍA Y MUCHO MÁS
- 43.1 NUEVOS PRODUCTOS - EL FUTURO DE LA LIMPIEZA SE LLAMA NEVEK®
- 43.2 NUEVOS PRODUCTOS - CICLOMETICONAS: ¿DE QUÉ ESTAMOS HABLANDO?
- 43.3 MÁS INFORMACIÓN - LUCHAR CONTRA LA HUMEDAD
- 42.1 NUEVOS PRODUCTOS - EVA ART
- 42.2 TRABAJOS EN CURSO - LA ANOXIA LLEGA AL MUSEO DEL PALACIO DE TOPKAPI
- 42.4 FORMACIÓN E INFORMACIÓN - DESAPARECE TAMBIÉN EL MOWILITH DS 5/2
- 42.3 NUEVOS PRODUCTOS - LAS ASPIRACIONES JUSTAS
- 41.1 NUEVOS PRODUCTOS - NANO ESTEL (SEGUIMOS INVESTIGANDO)
- 41.2 QUÍMICA E INVESTIGACIÓN - COLORES ESTABLES CON LOS LEDS HI-CRI
- 41.3 QUÍMICA E INVESTIGACIÓN - INTRODUCCIÓN AL PAPEL HANJI
- 40.2 QUÍMICA E INVESTIGACIÓN - LO QUE QUEDA...
- 39.2 QUÍMICA E INVESTIGACIÓN - AGARART: ¡SABEMOS ALGO MÁS!
- 38.1 MÁS INFORMACIÓN - EPO 150: APLICACIONES EN EL SECTOR ARQUEOLÓGICO
- 38.2 NUEVOS PRODUCTOS - NOVEDADES EN LA LÍNEA GAMBLIN
- 38.3 MÁS INFORMACIÓN - ESTEL 1000 EN EL TRATAMIENTO DEL CEMENTO
- 37.2 MÁS INFORMACIÓN - GEL PARA LA LIMPIEZA: ESTADO DEL ARTE Y DESARROLLOS DE LA INVESTIGACIÓN
- 36.1 MÁS INFORMACIÓN - CUANDO EL ENEMIGO ES EL MANGANESO
- 36.2 QUÍMICA E INVESTIGACIÓN - LOS VINÍLICOS, BAJO OBSERVACIÓN ESPECIAL
- 35.1 MÁS INFORMACIÓN - UN PROTECTOR IRREPRENSIBLE: SILO 111
- 32.2 QUÍMICA E INVESTIGACIÓN - AGARART Y LOS PROBLEMAS DE LAS PINTURAS MURALES MODERNAS
- 31.2 MÁS INFORMACIÓN - LOS MALENTENDIDOS ACERCA DE LA SALIVA.
- 31.3 NUEVOS PRODUCTOS - NANO ESTEL Y SUS PROPIEDADES AGLUTINANTES
- 30.2 OBRAS - PLM: LOS EXÁMENES NO TERMINAN NUNCA….
- 29.1 NUEVOS PRODUCTOS - NANO ESTEL: PRIMEROS RESULTADOS EXPERIMENTALES
- 29.2 NUEVOS PRODUCTOS - ¡POR FIN EL NUEVO BARNIZ DE RETOQUE!
- 28.3 MÁS INFORMACIÓN - CUBAS DE LAVADO
- 28.2 OBRAS EN EJECUCIÓN - ANOXIA EN EL CIBORIO DE VASARI
- 27.1 NUEVOS PRODUCTOS - UN CONSOLIDANTE ATÍPICO: NANO ESTEL
- 27.2 QUÍMICA E INVESTIGACIÓN - ADHESIÓN Y FLEXIBILIDAD: EPO 155
- 27.3 MÁS INFORMACIÓN - LA CAL LAFARGE
- 26.1 QUÍMICA E INVESTIGACIÓN
- 26.2 PROTECTORES ANTIPINTADAS PARA SUPERFICIES MONUMENTALES (II)
- 25.1 MÁS INFORMACIÓN - PROTECTORES ANTI ESCRITURA PARA SUPERFICIES MONUMENTALES
- 25.2 QUÍMICA E INVESTIGACIÓN - POLÍMEROS BAJO EXAMEN
- 25.3 MÁS INFORMACIÓN - ADITIVAR UN MORTERO
- 24.2 NUEVOS PRODUCTOS - GAMBLIN CONSERVATION COLORS
- 24.3 MÁS INFORMACIÓN - A VECES VUELVEN….
- 23.1 MÁS IMPORTANCIA - NMP ADIÓS!
- 23.2 MÁS INFORMACIÓN - LA BALSITE MULTIFORME
- 23.3 QUIMICA E INVESTIGACIÓN - LA PERCEPCIÓN DEL COLOR
- 22.1 NUEVOS PRODUCTOS - TECNOLOGÍA LED: EL FUTURO DE LA ILUMINACIÓN
- 22.2 MÁS INFORMACIÓN - ARMARIOS DE SEGURIDAD Y CERTIFICACIONES
- 22.3 MÁS INFORMACIÓN - ESCRUTANDO LO INVISIBLE
- 21.2 MÁS INFORMACIÓN - LIGROINAS, ¡QUÉ PASIÓN!
- 21.3 MÁS INFORMACIÓN - CÁNCER DEL BRONCE
- 20.1 FORMACIÓN E INFORMACIÓN - BODAS DE PLATA
- 20.2 NUEVOS PRODUCTOS - AGARART: EL AGUA MENOS LÍQUIDA
- 20.3 MÁS INFORMACIÓN - EL COBRE Y SUS ALEACIONES
- 19.2 MÁS INFORMACIÓN - EL TEMPLUM A PRUEBA DEL TIEMPO
- 19.3 MÁS INFORMACIÓN - PLATA “RESPLANDECIENTE”
- 18.1 QUÍMICA E INVESTIGACIÓN - PLM ¡DESDE HACE VEINTE AÑOS BAJO EXAMEN!
- 18.2 NUEVOS PRODUCTOS - ESPONJA DE CONTACTO
- 18.3 MÁS INFORMACIÓN - OBRAS EN HIERRO: CONVERSIÓN Y PROTECCIÓN – PARTE II
- 17.1 NUEVOS PRODUCTOS - MICRO EMULSIONES ACRÍLICAS
- 17.2 NUEVOS PRODUCTOS - HACIA UN NUEVO NEW DES
- 17.3 MÁS INFORMACIÓN - LO “COMPLEJO” DEL HIERRO (PARTE I)
- 16.1 QUÍMICA E INVESTIGACIÓN - LA SOLUCIÓN EN EL INTERCAMBIO (AMBERLITE IR 120 H)
- 16.3 MÁS INFORMACIÓN - ¿VERDE? DIFÍCIL
- 15.1 NUEVOS PRODUCTOS - EL RENACIMIENTO DEL FLÚOR POLIETILENO
- 15.2 QUÍMICA E INVESTIGACIÓN - APAGAR LOS “FUEGOS LENTOS”
- 15.3 MÁS INFORMACIÓN - LAS EDADES DEL HIERRO
- 14.1 AL PRINCIPIO FUE EL AGUA DE CAL
- 14.2 NUEVOS PRODUCTOS - EL NANO Y EL MICRO
- 14.3 MÁS INFORMACIÓN - VAMOS CON PIES DE PLOMO
- 13.3 MÁS INFORMACIÓN - «NEL BLU DIPINTO DI BLU»
- 12.3 MÁS INFORMACIÓN - BLANCO: UNA CUESTIÓN DE FONDO
- 10.1 QUÍMICA E INVESTIGACIÓN - LA DESACIDIFICACIÓN (1ª PARTE)
- 10.3 MÁS INFORMACIÓN - TIERRAS NATURALES
- 8.2 MÁS INFORMACIÓN - AQUÍ UN VIEJO CONOCIDO: EL ÓXIDO
- NOTICIAS Y NOVEDADES CTS
-
REALIZACIONES
- SUMINISTRO DE EQUIPOS ESPECIALIZADOS PARA EL MUSEO DE LOS DINOSAURIOS
- INSTALACIÓN EN EL ARCHIVO MUNICIPAL DE SEGOVIA
- INSTALACIÓN DE MOBILIARIO EN LA REAL ACADEMIA DE EXTREMADURA DE LAS LETRAS Y LAS ARTES (Palacio de Lorenzana, Trujillo, Cáceres)
- ¡Novedad desde el Museu de la Conca Della!
- Protegiendo el Patrimonio Cultural: Entrega de Armarios de Seguridad al Museo Arqueológico de Gandía
- Instalación del Clasificador CLASSIC A0 10 cajones en el Museo Vostell Malpartida
- Innovación en Almacenamiento y Conservación en el Instituto Estudios Albacetenses
- CTS Conservation: Aliado Técnico en la Preservación del Legado Prehistórico de la Fundación Dinópolis
- PRESENTACIÓN DEL SISTEMA DE DESINFECCIÓN MEDIANTE ANOXIA – CTS ESPAÑA
- CTS EN OPORTO CON ISOLCELL MISTRAL D MOBILE
- INSTALACIÓN DEL EQUIPO DE DESINFECTACIÓN POR ANOXIA EN ATMÓSFERA CONTROLADA EN LA ESCUELA DE ARTE DE VALLADOLID
- CTS en la FUNDACIÓN REAL FÁBRICA DE TAPICES DE MADRID
- CTS en la ESCRBC
- CTS EN EL MUSEO DE LAS COLECCIONES REALES - PATRIMONIO NACIONAL
- RETABLO MAYOR DE LA PARROQUIA DE LA ASUNCIÓN DE PRIEGO DE CÓRDOBA
- Equipos de Anoxia CTS en la Museo y Parque Arqueologico Cueva Pintada (Gran Canaria - Espana)
- Equipos CTS en la Fundación Real Fábrica de Tapices de Madrid
- CTS en Braga - Portugal (AOF- AUGUSTO OLIVEIRA FERREIRA & CA LDA)
- CTS ESPAÑA EN EL CENTRO DE RESTAURACIÓN DE BIENES MUEBLES DE CATALUÑA.
- CTS ESPAÑA EN EL MUSEO DE SALAMANCA
- CTS EN EL CENTRO DE CONSERVACIÓN Y RESTAURACIÓN DE BIENES CULTURALES DE CASTILLA Y LEÓN
- EQUIPO DE DESINFECTACIÓN MEDIANTE ANOXIA EN EL MUSEU D'ART CONTEMPORANI DE BARCELONA (MACBA)
- ARCHIVO HISTÓRICO PROVINCIAL DE TOLEDO
- EQUIPO DE DESINFECTACIÓN MEDIANTE ANOXIA EN LA FUNDACIÓN EDADES DEL HOMBRE
- DESINSECTACIÓN EN EL ARCHIVO REGIONAL DE MURCIA
- DECK 4000 EN GALERÍAS PUNTA BEGOÑA (Getxo, Bizkaia)
- CTS EN EL LABORATORIO DE RESTAURACIÓN DE LA ARCHIDIÓCESIS DE SEVILLA.
- DESINSECTACIÓN EN EL MUSEU DA CIÊNCIA UNIVERSIDADE COIMBRA
- DESINSECTACIÓN CON ISOSEP MISTRAL D MOBILE EN LA DIPUTACIÓN DE CASTELLÓ
- CTS EN EL MUSEU NACIONAL DE HISTÓRIA NATURAL E DA CIÊNCIA EN LISBOA
- CTS EN LA UNIVERSIDADE DO PORTO
- YACIMIENTO ARQUEOLÓGICO VILLA ROMANA DE FUENTE ÁLAMO - PUENTE GENIL - CÓRDOBA (ESPAÑA)
- ESCUELA DE FORMACIÓN COMPLUTUM - ALCALÁ DE HENARES - MADRID (ESPAÑA)
- MUSEO ARQUELÓGICO REGIONAL - ALCALÁ DE HENARES - MADRID (ESPAÑA)
- CENTRO DE RESTAURACIÓN E INTERPRETACIÓN PALEONTOLÓGICO DEL HOSTALETS DE PIEROLA - BARCELONA (ESPAÑA)
- MUSEO DEL PRADO - MADRID (ESPAÑA)
- OFERTAS ESPECIALES CTS
- BLOG CTS
- SOSTENIBILIDAD
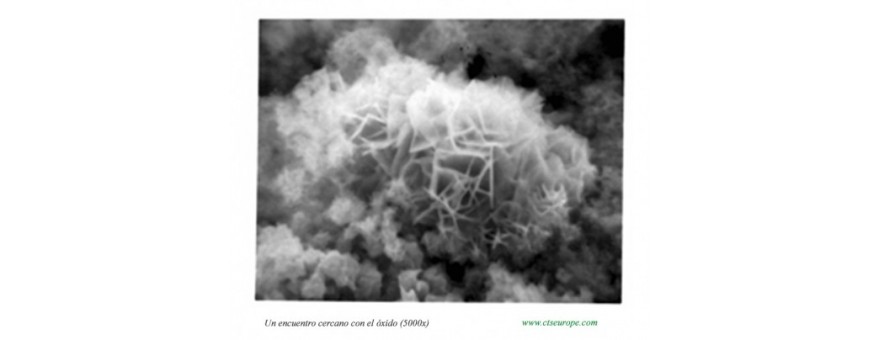
8.2 MÁS INFORMACIÓN - AQUÍ UN VIEJO CONOCIDO: EL ÓXIDO No hay productos en esta categoría
Un viejo conocido: el óxido
Una grapa de hierro, una reja sin mantenimiento, un perno introducido en una restauración anterior: ahí está la mancha de óxido que se extiende lentamente en una base de mármol o en el interior de la porosidad del almohadillado de arenisca… Poco a poco los compuestos ferrosos se combinan íntimamente con los cristales de carbonato cálcico, la sílice y el problema parece casi irresoluble… ¡y quizás realmente lo sea! Vamos por orden: ¿qué es exactamente el óxido?
Podemos definirlo como una mezcla de óxidos hidratados y carbonatos de hierro derivados de la oxidación del hierro metálico, en presencia de humedad, según la reacción:
Fe + 3/2 O2 + H2O → 2FeO(OH)
2Fe + 3/2 O2 + H2O → Fe2O3.(H2O)
Hay que recordar que el hierro puede oxidarse en dos estados de oxidación: Fe2+ y Fe3+; sin embargo, predomina el Fe3+, especialmente en un medio alcalino en el que se forma el hidróxido Fe(OH)3 con el característico color naranja-pardo, al que por brevedad se hará referencia en adelante, recordando que también existe una gran variedad de productos derivados de transformaciones posteriores, como la hematites roja (Fe2O3) o la magnetita negra (Fe3O4).
Son varios los productos utilizados para eliminar el óxido, pero todos son quelantes (enlace folleto quelantes).
Es conocida la acción quelante del ión fluoruro en el medio ácido y el clásico remedio para eliminar las manchas de óxido de los tejidos es precisamente una solución de ácido fluorhídrico. Sin embargo, es imposible utilizarla en un soporte pétreo, especialmente si está carbonatado, puesto que por la acidez muy fuerte de este reactivo al final de la operación quedaría muy poco soporte….. Por esta misma razón no es oportuno utilizar el ácido cítrico, sino sus sales (de sodio o amonio), trabajando con pH neutro o alcalino. Sin embargo, el citrato de sodio podría crear problemas en presencia de fuertes sulfataciones de la piedra, formando el sulfato de sodio, y por lo tanto es mejor utilizar el citrato de amonio (el constituyente de la Saliva Sintética CTS, que se obtiene simplemente añadiendo amoniaco al ácido cítrico). Con el citrato de amonio con exceso de amoniaco (para trabajar con seguridad con pH>9) se forman unos complejos hierro-amonio-citrato de color rojo-pardo, solubles en agua, mezclándose fácilmente en el agua de lavado. Entre los quelantes más eficaces con el ión Fe3+ está el conocido EDTA, con una constante de complejación muy alta. El problema principal a la hora de utilizar este quelante es su afinidad también con el ión Ca2+: este quelante puede ser extremadamente agresivo con el mármol, ya que se une al calcio y cede H+, con un efecto global de liberación de acidez y posterior disolución del aglutinante carbonatado. Esta vez la medición del pH puede ser engañosa: el EDTA disódico tiene pH 4,5 y podría parecer más agresivo que el tetrasódico, con pH 11. Sin embargo, puesto que el pH óptimo de complejación del calcio es 10, es preferible utilizar el disódico. Unos problemas similares a los del EDTA se pueden observar con otros quelantes como el tartrato.
Está claro que el EDTA tetrasódico puede utilizarse en todos los casos en que la complejación del calcio no sea un problema (madera, cuero, tejidos, etc.).
En caso de superficies carbonatadas, es mejor aprovechar la fuerte afinidad del hierro con el oxígeno, utilizando fosfatos de vario tipo. Hace tiempo que en el campo de la restauración se propuso la utilización del sodio hexametafosfato, con el que se obtienen buenos resultados con la aplicación repetida de compresas. En efecto, en este caso la acción con el carbonato cálcico es mucho más débil y el pH de la solución es neutro (6,7).
Como apuntado al principio, para las rocas calizas los óxidos metálicos procedentes de fuentes externas pueden haber intervenido en los procesos de solubilización/recristalización activos en presencia de agua (de lluvia o por humedad ascendente o infiltración). En este caso la “mancha” ya está incorporada en los cristales de calcita y su eliminación puede ser imposible sin “pelar” la superficie: no cabe más que aceptar el daño estético, contentándose con reducirlo. Por último, tampoco hay que olvidar que si el monumento seguirá expuesto al exterior, habrá que eliminar el origen del problema (por ejemplo, aislando la parte metálica con sistemas de protección tipo Incral 44/Cera Reswax), así como reducir la posibilidad de agresión de la piedra por las posibles soluciones salinas (con hidrófugos de distinto tipo a los que se dedicará un número del Boletín CTS).
Tampoco hay que olvidar el problema similar que presenta la oxidación de las aleaciones de cobre y que afecta a estatuas de bronce, cubiertas y canalones de cobre, etc. En este caso se producen las típicas manchas verdes, originadas por una gran variedad de productos de corrosión del cobre, como atacamita y paratacamita [oxicloruros Cu2(OH)3Cl], carbonatos básicos como malaquita (verde) y azurita. Como recordaba M. Laurenzi Tabasso en un escrito reciente sobre las bases de monumentos de bronce, el tipo de estas manchas depende tanto del entorno como de la composición del bronce que las origina, y el problema es básicamente estético al no haberse observado fenómenos de mayor degradación en las zonas “coloreadas”. Para la eliminación de las manchas se han propuesto varias mezclas quelantes aplicables con compresa, como la de carbonato de amonio (10%) y sodio hexametafosfato (10%), que sin embargo puede utilizarse solo si ya se ha retirado el objeto que ha causado la mancha; de lo contrario, el amonio pone de nuevo en marcha la solubilización del cobre.
También parece dar buenos resultados una mezcla de oxalato de amonio (5%) y carbonato de amonio (15%), pero en este caso debe evaluarse el efecto de deposición del oxalato de calcio en la superficie.
PRODUCTO:
EDTA SAL BISÓDICA
Link:https://shop-espana.ctseurope.com/319-edta-sal-bisodica
EDTA SAL TETRASÓDICA
Link:https://shop-espana.ctseurope.com/318-edta-sal-tetrasodica
Bibliografía:
· Laurenzi Tabasso M. “La conservazione dei basamenti dei monumenti bronzei” in Monumenti in bronzo all’aperto, Firenze, Nardini Ed., 107-112
· Matero F.G.; Tagle A.A.; “Cleaning, iron stain removal, and surface repair of architectural marble and crystalline limestone: the Metropolitan Club”; Journal of American Inst. for Conservation, 34 (1995), 49-68.
· Thorn A.; “Treatment of heavily iron stained limestone and marble”; ICOM 14th Triennial Meeting, The Hague, 888-894.





